Организация хранения лекарственных средств: новые требования Минздрава России
Новые обязанности руководителей: план реализации приказа № 260н
Реализация приказа Минздрава № 260н потребует пристального внимания руководителя медицинской организации – именно ему придется выполнять новые обязанности, либо выбрать ответственное лицо для их выполнения. Что необходимо сделать в первую очередь – предлагаем пошаговый план.
1. Создать локальные акты организации – СОПы, определяющие порядок совершения работниками действий при осуществлении:
- хранения лекарственных средств;
- обслуживания и поверки измерительных приборов и оборудования;
- ведения записей, отчетов и их хранения;
- приемки, размещения лекарственных средств.
2. Организовать контроль за соблюдением указанных СОПов.
3. Назначить лицо, ответственное за соблюдение правил хранения лекарственных препаратов, которое, в свою очередь, обязуется:
- осуществлять мониторинг эффективности системы;
- проводить плановые внутренние аудиты;
- проводить расследования каждого случая нарушения правил хранения;
- разрабатывать корректирующие действия при выявлении нарушений.
Важно: каждое нарушение требований должно быть зафиксировано, проанализировано и устранено с указанием: конкретных корректирующих мер, сроков их реализации, ответственных лиц. Система инцидентного анализа ЦСМК функционирует в полном соответствии с обязательным алгоритмом.
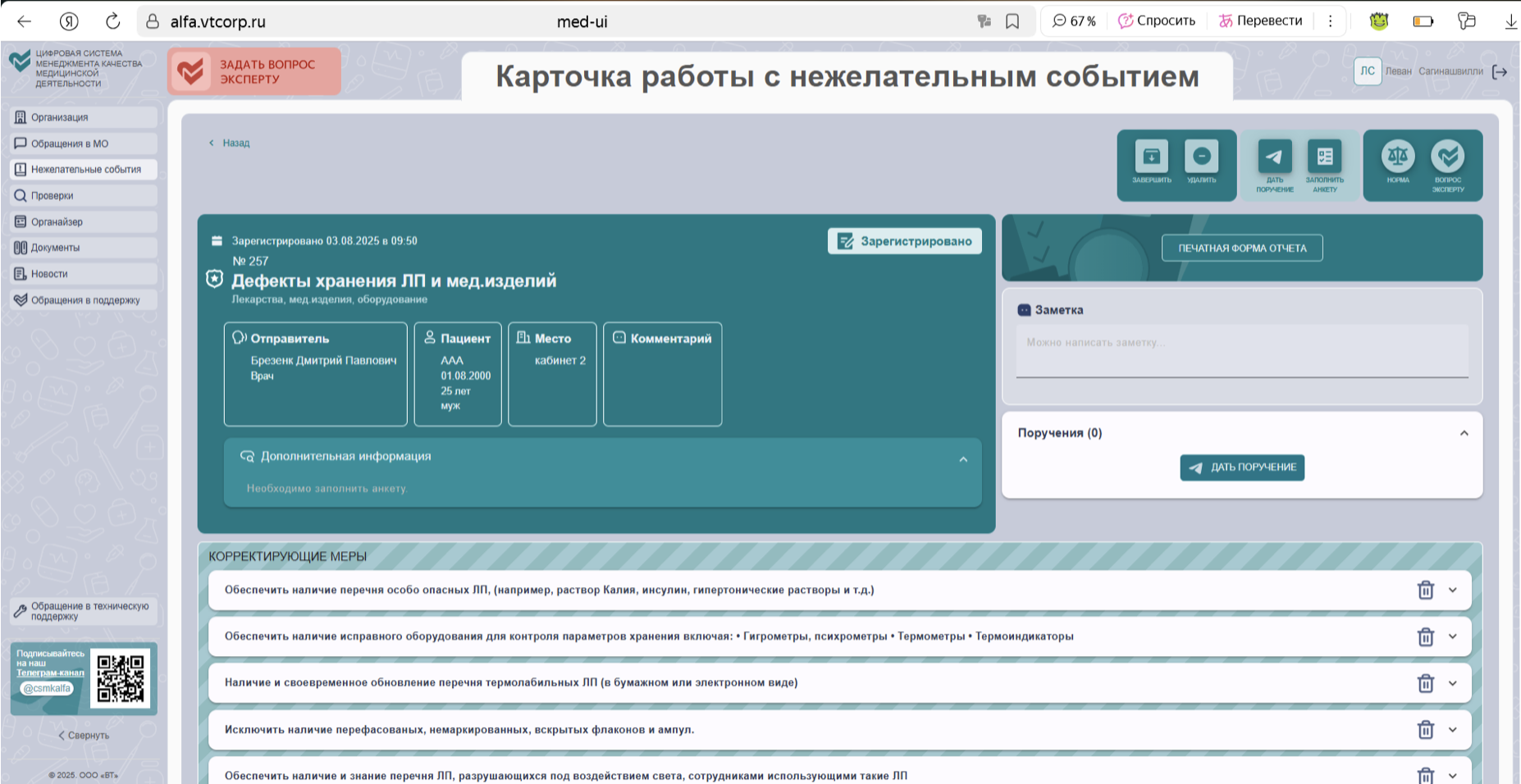
4. Определить функциональную зонификацию помещений – критически важно для предотвращения смешения, порчи или хищения лекарств.
Площади хранения должны быть разделены на следующие зоны:
- Приемки – с выделенной зоной для очистки тары.
- Основного хранения – для стандартных лекарственных средств.
- Специальных условий – для препаратов, требующих соблюдения температурного режима или иных условий (например, светозащиты, влажности).
- Карантинная зона – для лекарств, ожидающих проверки (отдельно, с ограниченным доступом, в запирающихся шкафах).
- Хранения проблемных препаратов – включает в себя:
- фальсифицированные, контрафактные, недоброкачественные средства;
- препараты без идентификации в системе мониторинга;
- средства с заблокированным оборотом;
- приостановленные или запрещенные к применению;
- с истекшим сроком годности;
- нарушающие требования ФЗ № 61-ФЗ.
- Отбора проб – для проведения контроля качества.
- Экспедиции (отгрузки) – для подготовки к отпуску.
Особое внимание в новом приказе уделено изоляции проблемных и потенциально опасных препаратов — они должны храниться отдельно, с ограничением доступа, в закрытых шкафах или помещениях. Это снижает риски их случайного использования и обеспечивает прослеживаемость.
5. Обеспечить наличие оснащения помещений для хранения оборудованием:
- Климат-контроль: системы кондиционирования, холодильные камеры и шкафы.
- Средства измерения: термометры и гигрометры, прошедшие поверку и калибровку в соответствии с законодательством об обеспечении единства измерений, и/или автоматизированные системы мониторинга: круглосуточный контроль температуры и влажности с архивацией данных. Примечательно, что в приказе определен базовый режим хранения лекарств — комнатная температура от +15°C до +25°C и относительная влажность не более 65%. Однако эти параметры действуют только при отсутствии особых указаний производителя на упаковке.
- Системы безопасности: пожарная и охранная сигнализации, контроль доступа.
- Складское оборудование: стеллажи, поддоны, погрузочно-разгрузочные средства.
6. Проконтролировать размещение лекарств согласно одному из указанных ниже свойств:
- физико-химические свойства;
- фармакологические группы;
- способы введения;
- агрегатное состояние субстанции.
7. Ежедневно (включая выходные и праздники):
- фиксировать температуру и влажность;
- вести журнал учета (на бумаге или в электронном виде с архивацией);
Особое внимание уделено лекарствам с ограниченным сроком годности (менее 6 месяцев): их наличие и сроки должны фиксироваться отдельно.
Практические рекомендации для пользователей ЦСМК
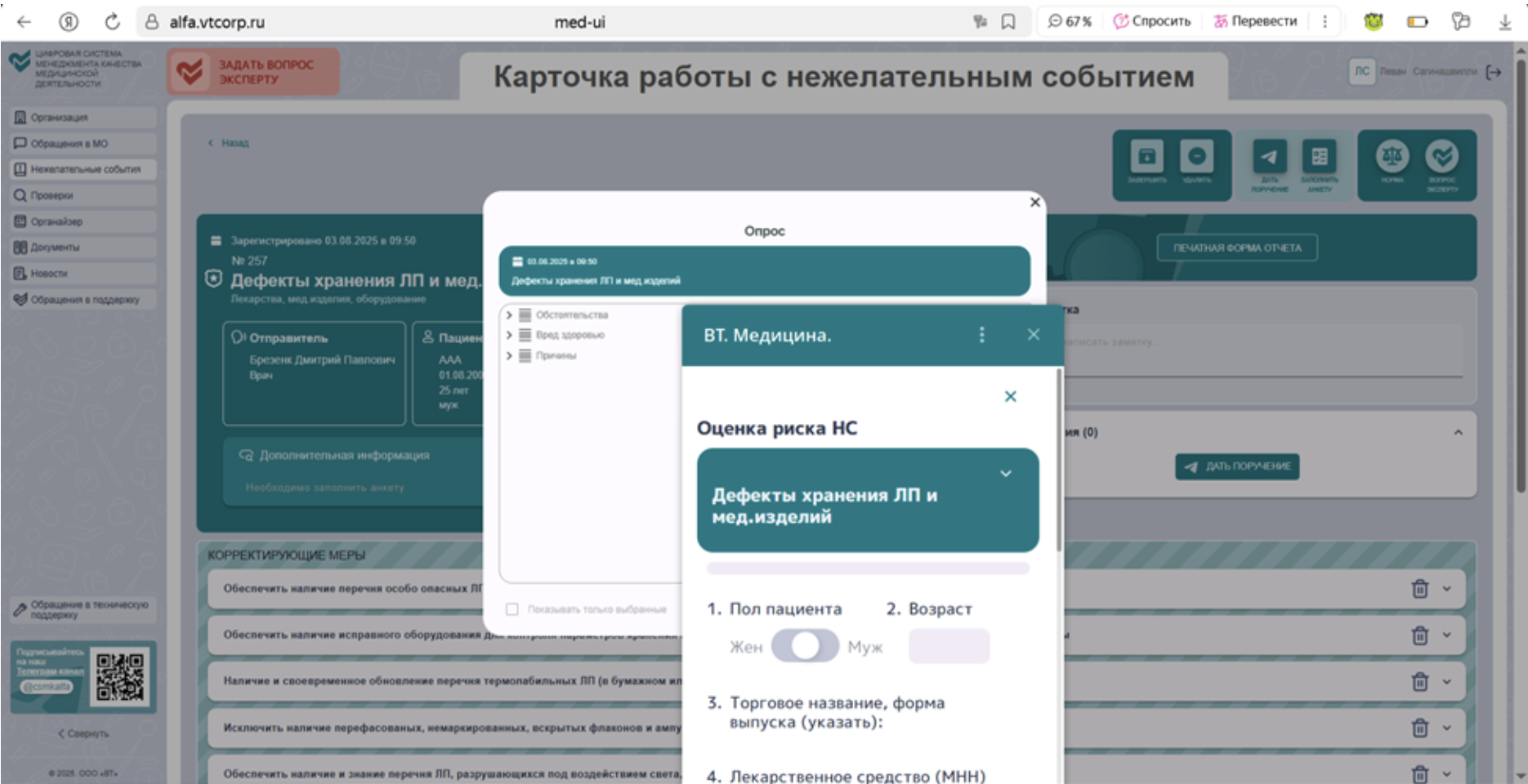
Мы уже обновили проверочный лист «Безопасность обращения лекарственных средств при осуществлении медицинской деятельности» и создали папку «Лекарственная безопасность». Для соответствия новым требованиям Минздрава к организации хранения лекарственных средств вам необходимо пройти четыре шага до 1 сентября 2025 года:
Шаг 1. Сформировать и подписать обновленные документы, ознакомить с ними сотрудников под подпись в листе ознакомления, приложить к системе документы из папки «Лекарственная безопасность».
Шаг 2. Провести внутреннюю проверку по проверочному листу «Безопасность обращения лекарственных средств при осуществлении медицинской деятельности». Функция «Редактировать план» позволит включить эту проверку в план, даже если ранее вы ее не предусмотрели. Новый проверочный лист поможет сотрудникам сориентироваться в новых правилах и фактически пройти обучение, а конкретные рекомендации сократят время и исключат ошибки.
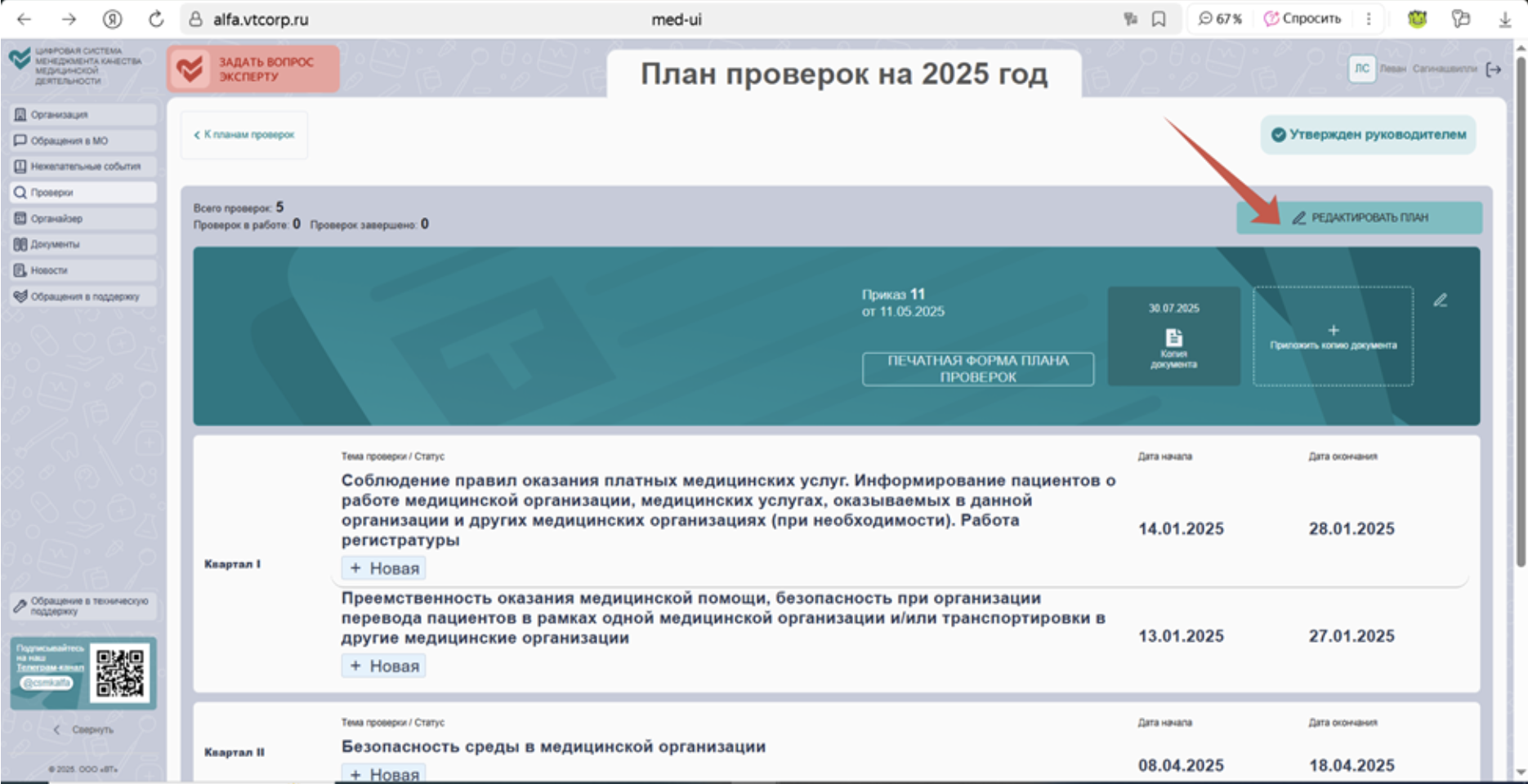
Шаг 3. Провести инвентаризацию оборудования и организовать поверку средств измерений.
Шаг 4. Обеспечить зонирование складских помещений в соответствии с требованиями.
 Наши возможности: вебинар о ЦСМК
Наши возможности: вебинар о ЦСМК  Навигация по системе ЦСМК
Навигация по системе ЦСМК  Подписывайтесь
Подписывайтесь 











